Les procédures accélérées de mise sur le marché, de plus en plus fréquemment utilisées pour les anticancéreux, bénéficient-elles réellement aux patients?
Article adapté d’un thread Twitter – en savoir plus
Deux nouvelles études publiée dans le @JAMA_current par @oncology_bg et coll dans le cadre de @PORTAL_Research : Revue des anticancéreux ayant bénéficié d’une procédure accélérée par la FDA (Food and Drugs Administration)
Entre 1992 et 2017 des anticancéreux ont bénéficié d’une procédure accélérée dans 93 indications sur la base des critères intermédiaires .
NB: lorsqu’on utilise des critères intermédiaires ou subsidiaires ou de substitution, qui sont des critères, par exemple biologiques, comme la mesure de biomarqueurs, ou des critères d’imagerie, comme la progression de la tumeur, ceux-ci remplacent les critères cliniques, c’est à dire l’amélioration mesurable de la maladie chez les patients, qui doit se traduire par un prolongement significatif de la survie globale dans le cas du cancer. Ces critères intermédiaires sont supposés, mais ce n’est souvent pas le cas, précéder une amélioration clinique du patient. Ils sont plus rapides et faciles à atteindre, et donc permettent de réduire le coût des essais cliniques et de commercialiser plus rapidement un anticancéreux dans une indication précise, mais ne permettent pas d’affirmer que le médicament bénéficiera réellement aux patients fda.gov/media/71195/do… Les procédures accélérées sont accordées de plus en plus fréquemment aux anticancéreux dans différentes indications au nom de l’urgence (les patients attendent des médicaments qui puissent les sauver) et les anticancéreux pour lesquels une procédure accélérée avait été accordée pour une indication donnée étaient censés, d’après la FDA, démontrer ultérieurement qu’ils étaient réellement bénéfiques pour les patients dans cette indication.
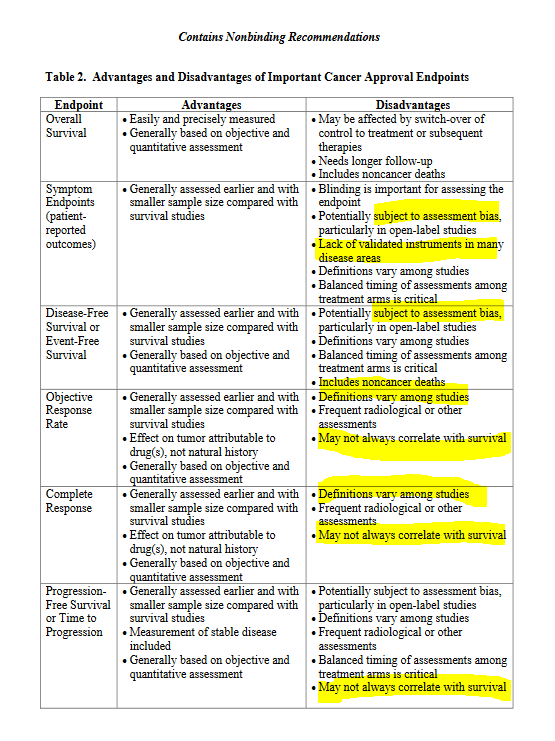
Au moment de l’étude en 2019 seulement 20% soit une indication sur 5 (19/93) avait démontré une efficacité pour prolonger la survie des patients (OS= overall survival ou survie globale, les patients acceptent de prendre des traitements ayant des effets indésirables souvent graves dans l’espoir de vivre plus longtemps) jamanetwork.com/journals/jamai…
Aucune de ces indications n’a montré sa capacité à améliorer la qualité de vie des patients cancéreux, ce qui est, avec la survie globale, le deuxième critère impliquant un bénéfice clinique pour le patient et pouvant justifier l’utilisation des anticancéreux.
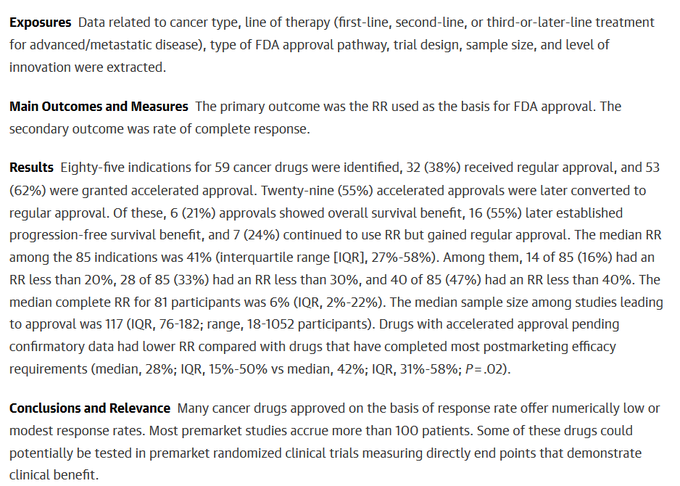
Plus récemment, de nouveaux critères intermédiaires encore plus vagues et arbitraires ont été introduits comme le “taux de réponse”, ou “response rate” (RR). Le taux de réponse est le pourcentage de patients qui voient une réduction de la taille de leur tumeur à l’imagerie en dessous d’un seuil choisi par le promoteur, c’est-à-dire généralement la firme pharmaceutique qui est propriétaire du produit évalué. Il n’y a généralement pas de bras comparateur. On peut dire alors que le promoteur choisit le critère d’évaluation qui l’arrange. Ce critère, le taux de réponse, est utilisé au cours de procédures de mise sur le marché et d’indications d’anticancéreux décrites comme standard (c’est-à-dire non accélérées).
Une revue des autorisations d’indications par la FDA de 2006 à 2018 montre que le taux de réponse est plus faible lorsque ce critère est utilisé dans le cadre de procédures accélérées et que, compte tenu du nombre de participants, certaines de ces autorisations auraient pu être données sur la base d’essais randomisés évaluant la survie plutôt que sur des critères arbitraires sur bras unique jamanetwork.com/journals/jamai…
Ainsi, bien que la FDA s’enorgueillisse de n’avoir retiré du marché que 5% des anticancéreux approuvés sur la base d’une procédure accélérée ncbi.nlm.nih.gov/pubmed/29494733 cela correspond en réalité à une baisse de ses exigences et non à une efficacité démontrée des anticancéreux mis sur le marché grâce à des procédures accélérées.
La FDA accepte de plus en plus souvent d’autoriser des indications pour des anticancéreux qui ne présentent aucun bénéfice pour les patients cancéreux et demeure peu transparente sur ses motivations qui témoignent d’un phénomène de capture du régulateur (https://thejournalofregulation.com/fr/article/capture-du-regulateur/)
Cette capture expose les patients à subir de plus en plus fréquemment des effets indésirables de traitements dont il ne peuvent tirer de bénéfices. Mais elle expose également l’ensemble de la société à investir une part croissante des moyens destinés à améliorer la santé pour financer des traitements qui ne l’améliorent pas, voire, la dégradent.

Twitter est un réseau social qui permet à l’utilisateur d’envoyer des messages courts (tweets) n’excédant pas 280 caractères (ce qui explique l’emploi fréquent d’abréviations). Un thread Twitter est une série de tweets qui se succèdent, émis par un même auteur pour former un contenu plus long. L’auteur peut d’ailleurs numéroter chaque tweet pour les ordonner. Cet article est une reprise sous format blog d’un thread Twitter dont voici l’origine :