Les essais de non infériorité sont de plus en plus fréquents, notamment en cancérologie. Ici j’explique quelles sont les limites des essais de non infériorité et en quoi ils peuvent être trompeurs.
Article adapté d’un thread Twitter – en savoir plus
Rappel: un essai clinique est fait, non au bénéfice des patients inclus dans l’essai clinique mais pour 2 raisons : 1-obtenir une autorisation de mise sur le marché 2- éventuellement apporter un bénéfice futur aux patients traités.
Obtenir l’AMM permet de commercialiser un médicament et, éventuellement, de le faire rembourser par des assurances privées ou publiques. Ceci est à l’avantage de l’industriel. Mais un médicament qui n’apporte aucun bénéfice pour le patient ne remplit pas l’objectif N°2
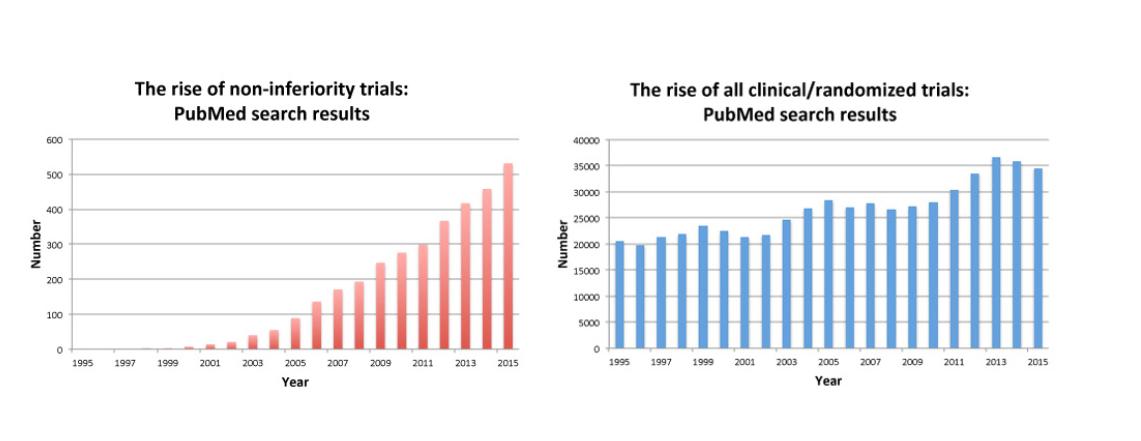
Qu’en est-il des essais cliniques de non infériorité? Hilda Bastian montre qu’ils sont en forte augmentation depuis quelques années
https://t.co/cTvrYQ8GqL?amp=1
Quel est le problème avec les essais de non infériorité?
D’abord, le problème est qu’un médicament comparé dans un essai clinique peut être à la fois inférieur et non inférieur au comparateur.
C’est un problème de définition et de cohérence. Le manque de cohérence est du côté des recommandations CONSORT pour l’interprétation des essais cliniques comme l’explique Vinay Prasad ici link.springer.com/content/pdf/10…
Cette incohérence aboutit à une situation telle qu’un médicament X peut être à la fois inférieur et non inférieur au comparateur Y comme l’explique le @ProfDFrancis (ici) qui donne des conseils pour faciliter l’interprétation


En fait, effectuer un essai de non infériorité, signifie qu’on accepte un certain niveau de détérioration des résultats du médicament testé par rapport au comparateur. Un niveau de détérioration défini par le sponsor, la FDA étant très tolérante sur le sujet.

En d’autres termes la FDA ne récuse un essai de non infériorité que si la marge choisie par le sponsor permet de considérer un médicament totalement inerte comme non inférieur
Mais ce sera plus facile à comprendre avec un dessin et j’en ai trouvé un ici. J’ai entouré le cas où un médicament est à la fois non inférieur et inférieur pour le guide CONSORT
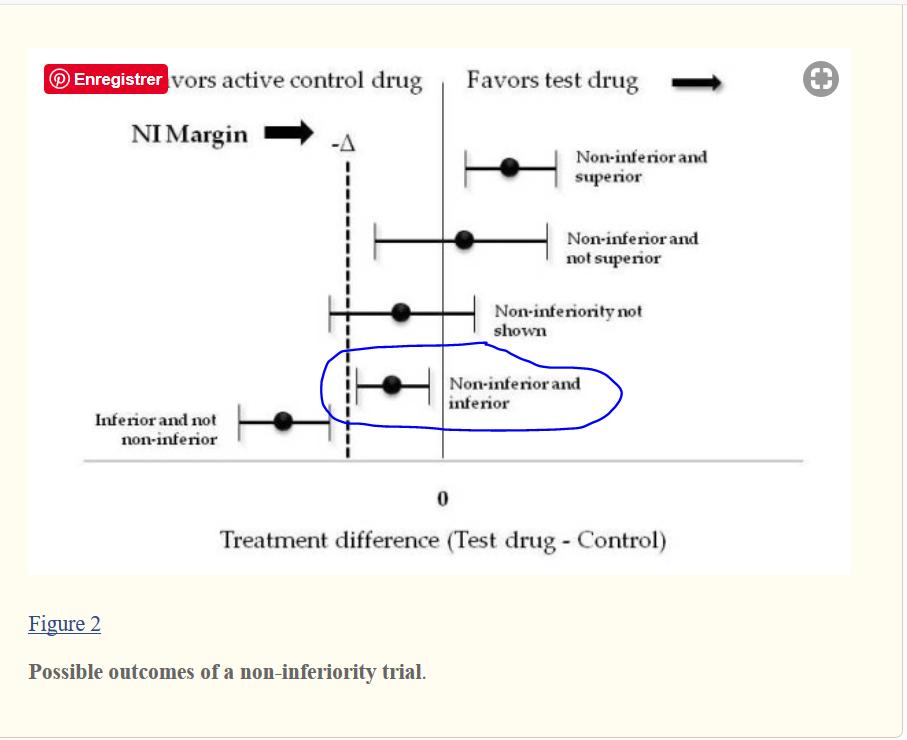
Du point de vue de la logique et du bon sens, ce médicament est tout à fait inférieur, mais si le sponsor prend une marge suffisamment importante et si l’essai a une puissance statistique suffisante (intervalle de confiance étroit) il peut être les deux du point de vue de CONSORT
Bishal Gyawali (@oncology_bg) vient de publier une étude dans le JAMA sur les essais de non infériorité en cancérologie qui ont pour critère principal la survie globale
Il a identifié 128 essais randomisés de non infériorité en cancérologie, dont 74 concernaient des médicaments et 23, incluant 21437 patients, avaient pour critère principal la survie globale.
Nous voyons déjà une partie du problème: inclure plus de 20 000 patients dans des essais cliniques en cancérologie sans l’espoir d’apporter la moindre amélioration de survie, mais seulement de limiter la réduction de la survie par rapport à un médicament existant, pose des problèmes éthiques.
Bishal Gyawali en avait parlé au sujet du suntinib (SUTENT), approuvé comme traitement adjuvant du cancer du rein non métastasé opéré, sur la base d’un essai de non infériorité contre placebo
https://t.co/PArTvQIyN2?amp=1
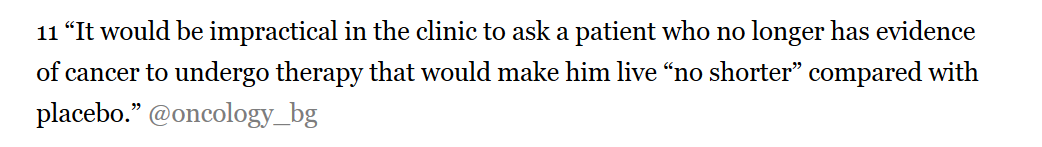
Certaines raisons peuvent justifier, légitimer, un essai de non infériorité dans lequel les patients risquent, par exemple, de vivre moins longtemps, notamment une amélioration de la qualité de vie.

Mais la FDA n’a pas de telles exigences et B.Gyawali constate que parmi les 23 essais 9 ne fournissent aucune justification pour effectuer un essai de non infériorité et 8 (89%) parmi ceux-ci font partie des 12 totalement financés par l’industrie
Par ailleurs, bien que la marge de détérioration de la survie aille de 8 à 33% de survie en moins; B. Gyawali et coll ne trouvent pas de corrélation négative de l’ensemble des essais avec la survie globale. Mais on ne peut pas dire que ce soit dû à la sévérité de la régulation.
La justification la plus fréquente de ce type d’ essais est une modification de la forme galénique du médicament: forme orale, plus facile d’emploi, versus forme injectable.
Les essais de non infériorité posent des problèmes de cohérence, de régulation et surtout d’éthique. Il est important de savoir ce qu’il en est car la FDA avait approuvé 18 sur 43 premières demandes de mise sur le marché sur la base d’essais de non infériorité


Twitter est un réseau social qui permet à l’utilisateur d’envoyer des messages courts (tweets) n’excédant pas 280 caractères (ce qui explique l’emploi fréquent d’abréviations). Un thread Twitter est une série de tweets qui se succèdent, émis par un même auteur pour former un contenu plus long. L’auteur peut d’ailleurs numéroter chaque tweet pour les ordonner. Cet article est une reprise sous format blog d’un thread Twitter dont voici l’origine :



