2017, la loi rend les vaccins contre le Méningocoque C, l’Hépatite B et le Pneumocoque obligatoires. Sur quelles bases scientifiques?
Ce texte correspond à l’annexe d’une prise de position de médecins généralistes contre le projet d’extension de l’obligation vaccinale pour les nourrissons. Elle a été adressée sous la forme d’une lettre ouverte à l’ensemble des députés et sénateurs, avec copie au premier Ministre, à la Ministre de la santé et au Président de la République, avant l’adoption du texte fin 2017.
Voici trois exemples de vaccins faisant partie du groupe des huit vaccins que la nouvelle loi rendrait obligatoires, qui ne remplissent pas les conditions pour représenter un apport de santé publique justifiant l’obligation et les sanctions lourdes imposées aux parents.
La proportionnalité des contraintes peut alors être mise en cause.
Contenu
Vaccin contre la méningite à méningocoque C
Contexte, épidémiologie
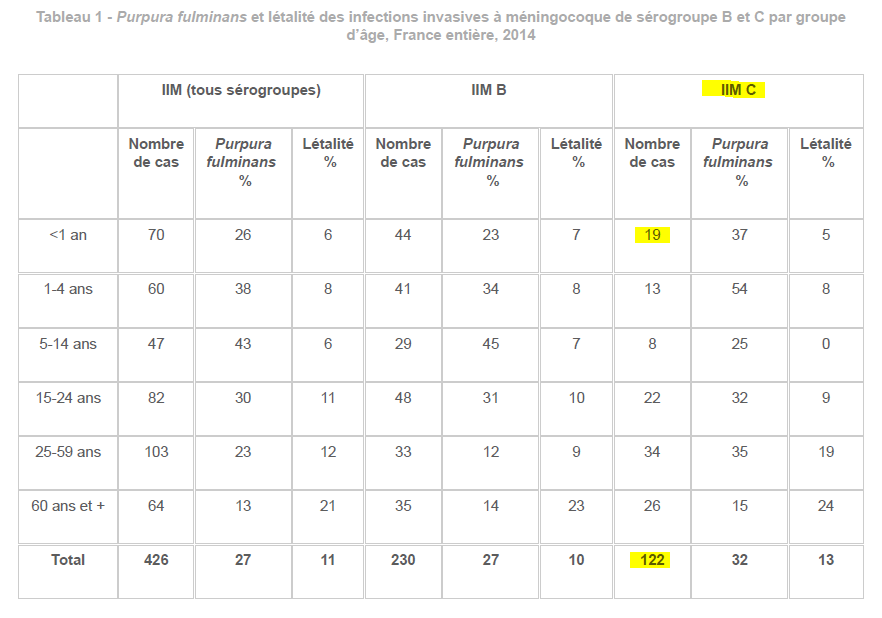
Prenons comme exemple la méningite à méningocoque C, efficacement contrôlée en France par une stratégie de vaccination ciblée autour des cas pendant les années 90 à 2010 . Cette stratégie, consistant à mobiliser les moyens publics pour prévenir d’autres cas dès qu’un cas de méningite se déclare a probablement contribué à réduire l’incidence de l’ensemble des méningites à méningocoque en France et à classer notre pays parmi les pays à faible incidence pour l’ensemble des méningites à méningocoque avec moins de 1 cas pour 100 000 habitants par an (environ 600 cas) au début des années 2000. Les pays dits « à forte incidence » comme la Grande Bretagne, l’Espagne ou l’Irlande, comptaient alors plus de 4 cas pour 100 000 habitants par an.
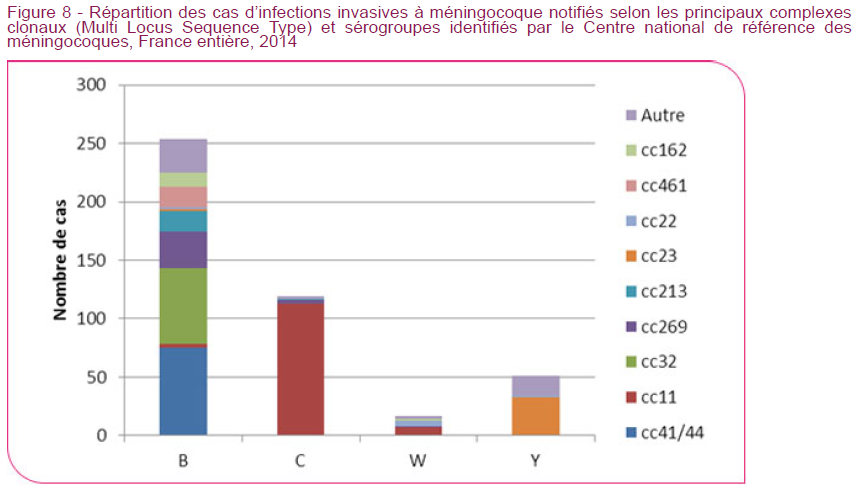
Le méningocoque est une bactérie et il existe plusieurs groupes de méningocoque. Les groupes A, B, C , W et Y, occupant tous la même niche écologique. Le méningocoque du groupe C est le deuxième groupe de méningocoque le plus fréquent en France et en Europe après le méningocoque du groupe B qui représente environ 70% des cas.
Avant 2010 et les recommandations de vaccination universelle des nourrissons, la France, faisait partie des pays à faible incidence pour les infections dues au méningocoque du groupe C avec 120 cas par an en moyenne de méningite dus à cette bactérie entre 1990 et 2010. Dit autrement, cela représente 2 cas par million d’habitants ou 0,2 cas pour 100 000. Avec une létalité de l’ordre de 11% , cela signifie qu’environ 15 décès par an dans l’ensemble de la population dont 1 à 3 décès en moyenne avant 15 ans sont provoqués par cette bactérie1INVS, les infections invasives à méningocoque en France en 2014..
Les méningocoques sont des bactéries habituellement présentes dans le pharynx et le méningocoque du groupe C est présent dans le pharynx de 10% de la population sans provoquer de symptômes. C’est ce que l’on appelle le portage asymptomatique des porteurs sains.
Stratégie vaccinale
La stratégie de vaccination ciblée autour des cas de méningite utilisée en France avant 2010 s’oppose à celle de la vaccination universelle des nourrissons. La vaccination universelle contre la méningite à méningocoque C est recommandée pour les nourrissons en France depuis 2010.
Pour le vaccin contre le méningocoque du groupe C, les effets indésirables graves du vaccin, nécessitant à minima une hospitalisation, seraient de l’ordre de un pour 20 000 doses de vaccin (ou 5 pour 100 000 doses), augmentant, logiquement, avec le nombre de doses2Bulletin d’information du département de pharmacologie du CHU de Bordeaux, N°64, décembre 2004.
En 2010, on a d’abord recommandé la vaccination par une seule injection de vaccin administrée à l’âge de 12 mois de manière concomitante au vaccin triple contre la rougeole les oreillons et la rubéole. En plus de cette vaccination, le Haut Conseil pour la Santé publique (HCSP) a recommandé une vaccination de rattrapage par une dose de vaccin jusqu’à 24 ans représentant environ 18 millions de doses de vaccin. Le rapport coût efficacité de cette mesure était jugé mauvais, même avec des hypothèses optimistes de succès. Depuis janvier 2017, le HCSP a ajouté une deuxième dose de vaccin à l’âge de 5 mois en primo vaccination.
La vaccination recommandée consiste donc désormais en une primo-vaccination à 5 mois et un rappel à 12 mois par un vaccin polyosidique conjugué à l’anatoxine tétanique. Il s’agit du vaccin Neisvac du laboratoire Pfizer qui est le seul qui possède l’AMM pour ce schéma vaccinal. La vaccination de rattrapage est toujours recommandée.
La protection conférée par ce vaccin, avec deux ou même trois doses ne persiste que quelques années lorsqu’on vaccine des nourrissons ou des jeunes enfants. Cela était connu et mentionné dans l’avis du HCSP recommandant la vaccination datant de 2010.
L’objectif affiché, officiel, de cette vaccination serait de diminuer fortement le portage pharyngé, c’est-à-dire la présence chez 10% de la population environ, de méningocoques de type C , en espérant ainsi éliminer totalement l’infection par ce sérogroupe.
Mais la vaccination ne peut pas garantir, même avec une couverture à 100% par deux doses comme cela est recommandé depuis janvier 2017, l’élimination de la maladie.
Sans compter que avec deux doses pour une maladie aussi rare, même dans l’hypothèse d’une efficacité maximale, le rapport coût-efficacité de ce vaccin devient très défavorable et dépasse largement le seuil habituellement toléré de 50 000 euros par année de vie théoriquement gagnée selon des hypothèses d’efficacité souvent optimistes.
Expériences européennes
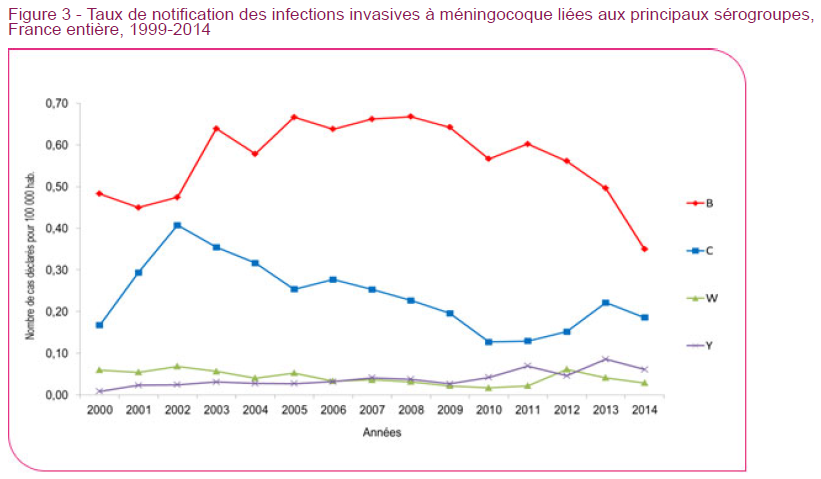
L’exemple britannique, comme celui d’autres pays européens, où la vaccination a été généralisée depuis plus de 15 ans, a démontré que l’élimination n’était pas un objectif accessible. En Grande Bretagne, qui est un pays où les infections à méningocoque C rapportées par le système de surveillance étaient environ 10 fois plus fréquentes qu’en France avant la vaccination, trois doses de vaccin ont été recommandées depuis 1999 chez le nourrisson de moins de un an, avec une couverture vaccinale très rapidement supérieure à 90%.
Après plus de 15 ans de vaccination universelle par trois doses et malgré l’introduction d’un rappel à l’adolescence, le nombre de cas de méningite à méningocoque C, a été réduit sans que la maladie ne soit éliminée. Le niveau actuel du nombre de cas de méningite à méningocoque de type C rapportés par le système de surveillance britannique est comparable à celui de la France (30 à 40 cas par an) .
Globalement, la vaccination de masse contre la méningite à méningocoque dans certains pays européens n’a pas modifié le classement des pays. Malgré la vaccination les pays à forte incidence pour le méningocoque sont restés ceux où ces infections sont les plus fréquentes .
En outre, un autre méningocoque (groupe W) émerge fortement chez les adolescents depuis que le rappel à l’adolescence a été recommandé et génère des épidémies chez les collégiens nécessitant des campagnes de vaccination massives et spécifiques. En Grande Bretagne, le méningocoque du groupe W semble bien prendre la place laissée vacante par le méningocoque du groupe C et à l’échelle européenne, la fréquence des infections par le méningocoque du groupe Y est en augmentation.
D’autre part s’il existe une réduction importante des méningites à méningocoque en Europe, pendant les années 2000, cela est dû en grande partie à l’importante diminution de la fréquence des infections par les méningocoques du groupe B. Le nombre de cas pour ce groupe est passé de 3400 en 2007 à 1766 en 20143Rapports annuels européens sur les infections invasives de l’ECDC, soit une diminution de 50% en 8 ans.
Le mérite du vaccin contre le méningocoque du groupe B ? Non, puisqu’il n’y avait pas de vaccin contre le méningocoque du groupe B. Cette évolution est probablement due à la réduction de certains facteurs de risque connus pour favoriser l’infection comme la promiscuité, et le tabagisme. Donc à l’amélioration de facteurs socio-économiques et relevant de la prévention.
En conclusion
Devant une maladie aussi rare et bien contrôlée par la vaccination ciblée, la stratégie de vaccination universelle, qui risque de beaucoup augmenter le nombre d’ effets indésirables chez les nourrissons sans permettre un bénéfice de santé publique, est discutable et ne représente pour le moins pas une urgence de santé publique.
Le rapport coût-efficacité de ce vaccin pour deux doses dépasse le niveau acceptable, même dans les hypothèses les plus optimistes sur son efficacité.
Compte tenu de la rareté de la maladie en France, de l’efficacité très partielle du vaccin, le risque que font courir des enfants non vaccinés à la collectivité est très discutable.
Voici deux autres exemples de vaccins pour lesquels la vaccination universelle obligatoire a un intérêt très discutable.
Vaccin contre l’hépatite B
Pourquoi augmenter la couverture vaccinale des nourrissons ne peut apporter aucun bénéfice ?
Contexte
Les vaccins contre l’hépatite B commercialisés en France, sont les vaccins hexavalents des laboratoires Sanofi et GSK et des vaccins monovalents, ne contenant que les vaccins contre l’hépatite B, de ces mêmes laboratoires. Les vaccins hexavalents sont administrés à 2, 4 et 11 mois selon les recommandations inscrites au calendrier vaccinal.

L’hépatite B est une maladie virale qui se transmet essentiellement par voie sexuelle, et par voie sanguine (toxicomanie , tatouages, activité professionnelle pour les professionnels de santé notamment) dans les pays à hauts revenus, et qui touche le foie.
Dans les pays pauvres d’Afrique noire et d’Asie du Sud-Est elle se transmet fréquemment de la mère à l’enfant pendant la grossesse, et aussi, parfois, entre enfants ou entre parents et enfants. Ce sont essentiellement les porteurs de la forme chronique qui transmettent la maladie.
En France, où la maladie est beaucoup plus rare sous ses différentes formes, la transmission entre enfants n’existe pas, et la transmission entre parents et enfants après la naissance est exceptionnelle et concerne très majoritairement les groupes à risque, c’est-à-dire des enfants ou adultes nés à l’étranger, dans des pays à forte incidence. Le virus ne circule donc pas parmi les enfants et ne sera pas transmis en collectivité.
L’infection se présente principalement sous trois formes : les nouveaux cas peuvent être aigus symptomatiques, la personne déclenche alors la maladie pendant quelques semaines, ou aigus asymptomatiques. Cette dernière forme représente environ 60% de ces nouvelles infections. La personne est alors infectée mais l’infection passe inaperçue. Une personne ainsi infectée sera immunisée par la suite.
Les enfants de plus de 5 ans et les adultes guérissent de l’infection et sont immunisés dans 95 à 98% des cas. Dans les 2 à 5% des cas restants la maladie peut devenir chronique. Dans ce cas, le virus dégrade progressivement le foie, et une personne sur cinq parmi celles présentant une forme chronique va évoluer, généralement au bout de plusieurs décennies, vers la cirrhose. Pour les enfants de plus de 5 ans et les adultes le risque d’évolution vers la cirrhose est donc d’environ un pour 100 personnes infectées.
Pour les jeunes enfants le risque de passage à la chronicité est plus important. Il va de 90% à la naissance, lorsque la mère est infectée et transmet le virus à l’enfant, puis diminue à 50% après 6 mois puis à 30% entre 1 et 4 ans4Antona D., Hépatite B en France. Aspects épidémiologiques et stratégie vaccinale, INVS, 2004.. En France, les femmes enceintes sont dépistées systématiquement, depuis 1993, pour savoir si elles sont porteuses de la forme chronique de l’hépatite B. Cela permet de faire une prévention à la naissance qui réduit de plus de 90% le risque d’infection du nouveau-né et de passage à la chronicité. Aucun nourrisson ne peut naître dans un hôpital ou clinique en France sans que l’on sache si lui ou sa mère sont porteurs du virus.
revoir lien ci-dessus
Fréquence et évolution spontanée
Les cas d’hépatite B sont en constante diminution en France depuis le milieu des années 80 et donc avant la campagne de vaccination menée au milieu des années 905INSERM, Incidence et prévalence de l’hépatite B en France.
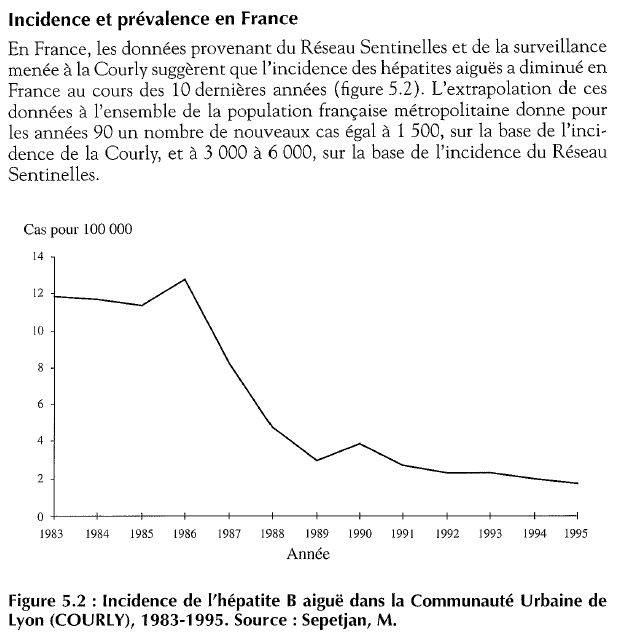
L’INVS estime actuellement à 291 cas le nombre d’hépatites aigües en France, ce qui représenterait quelques 700 infections annuelles en tenant compte des cas asymptomatiques6Cécile Brouard. INCIDENCE ET MODES DE TRANSMISSION DE L’HÉPATITE B AIGUË DIAGNOSTIQUÉE EN FRANCE, 2012-2014, Santé Publique France déc 2016.. Parmi ces cas 90% sont des adultes. D’autre part, plus de 80% des nouveaux cas d’hépatites chroniques en France sont constatés chez des personnes nées à l’étranger.

Extrapolation
Si l’on tient compte des nouveaux cas d’hépatite aigüe cela signifie que le nombre de cas d’enfants habitant en France contractant une infection par le virus de l’hépatite B est très faible, quelques 70 par an. Une étude britannique, réalisée alors que le dépistage systématique des mères n’existait pas au Royaume Uni, montrait que 50% des enfants porteurs d’une hépatite B chronique étaient nés à l’étranger et que 25% autres avaient des parents nés dans des pays à forte incidence pour l’hépatite B7Shalez N, Epidemiology and Clinical Features of Childhood Chronic Hepatitis B Infection Diagnosed in England, Pediatric Infectious Disease Journal, Vol. 33, No. 2, 02.2014, p. 130-135..
Autant dire, que, avec 70 cas chez les enfants et un risque de 1% de cirrhose parmi ces cas on ne peut espérer empêcher aucun cas de cirrhose en vaccinant des enfants nés en France de parents sans facteurs de risque particulier, qui représentent quelques 90% des enfants vaccinés.
Ce sont pourtant les 1500 cas de cirrhose qui sont mis en avant pour justifier la vaccination des nourrissons.
On peut rétorquer que le vaccin protégera ces enfants à l’âge adulte. Mais la raison pour laquelle la vaccination universelle contre l’hépatite B des nourrissons n’a pas d’utilité en termes de santé publique est aussi la durée de protection limitée du vaccin. Le groupe d’experts SAGE (Strategic advisory group of experts) de l’OMS a établi qu’aucune protection n’avait été démontrée pour des enfants vaccinés jeunes à l’âge adulte8Sage hepatitis working group. Should primary hepatitis B series be used for long-term protection against hepatitis B virus infection? Site de l’OMS.
Pour un tel vaccin, l’obligation vaccinale pour l’ensemble des nourrissons nés en France dont la quasi-totalité subiraient les risques d’effets indésirables associés au vaccin, sans pour autant pouvoir en attendre le moindre bénéfice, serait totalement injustifiable.
Brevets et fixation des prix
Il faut ajouter aux considérations épidémiologiques des considérations commerciales et noter que les laboratoires GSK et Merck ont acheté les brevets les plus importants pour ce vaccin ce qui leur permet de bénéficier financièrement de tous les vaccins contenant la valence hépatite B distribués dans le monde9IP Handbook of best practices , DNA Hepatitis B Vaccine: International Vaccine Institute, Korea.. Or, l’influence des laboratoires dans la recherche et les décisions concernant les vaccins se manifeste notamment à travers les conflits d’intérêts et n’est pas absente en France.
Vaccin contre le pneumocoque
Contexte
Il s‘agit du Prevenar 13, vaccin du laboratoire américain Pfizer. Ce vaccin est indiqué pour la vaccination universelle par trois doses à 2 mois 4 mois et 11 mois en même temps que le vaccin hexavalent. Il n’est pas indiqué chez les enfants en bonne santé après l’âge de deux ans car le taux d’infections invasives à pneumocoque diminue très rapidement après cet âge .

Le pneumocoque est une bactérie qui est considérée comme un hôte normal du pharynx. 60 à 70% des enfants de moins de 2 ans sont des porteurs sains de cette bactérie. Ils en ont dans le rhinopharynx et peuvent la transmettre sans être malades. Le portage diminue avec l’âge et devient faible vers 8 ans. Le portage permet l’immunisation des enfants contre les sérotypes concernés.
La transmission du pneumocoque se fait par les gouttelettes de salive.
A la faveur de facteurs favorisants, comme les traitements antibiotiques, la promiscuité, l’exposition à la fumée du tabac, ces bactéries peuvent coloniser le pharynx et provoquer des otites ou des pneumonies. Beaucoup plus rarement, en particulier chez des enfants fragiles comme les nourrissons prématurés ou les enfants porteurs de maladies chroniques ces bactéries peuvent provoquer des infections invasives à pneumocoque en passant dans le sang (bactériémies et septicémies), ou dans les méninges (méningites).
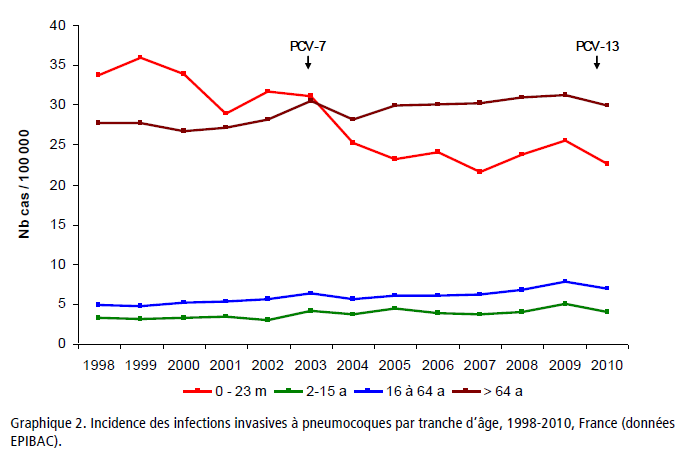
Comme pour la plupart des maladies infectieuses, le risque des infections invasives est relativement plus important chez les enfants de moins de deux ans pour qui les infections invasives à pneumocoque représentaient 27 cas pour 100 000 nourrissons avant l’introduction du vaccin. Toutefois cette tranche d’âge ne représente que 5 à 10% de l’ensemble des infections invasives à pneumocoque tous âges confondus.
Capacités d’adaptation
Le pneumocoque comporte 91 sérotypes capsulaires différents, et chaque sérotype répond à des anticorps différents et nécessite donc une immunisation spécifique. Les infections invasives à pneumocoque auront statistiquement plus de risques de se produire si des circonstances favorisantes interviennent.
Ces circonstances, décrites ci-dessus, tiennent principalement à l’état de santé des enfants et à leur environnement (notamment exposition au tabac) mais aussi aux modes de garde ou à l’importance de la fratrie.
Les sérotypes impliqués dans les infections invasives à pneumocoque ne sont pas les mêmes selon les pays. Il y a, par exemple, une différence importante, de l’ordre de 20%, entre les sérotypes retrouvés dans le pharynx en Amérique du Nord et en Europe.
Les sérotypes impliqués varient aussi avec l’âge et avec la pathologie. Ils ne sont pas les mêmes aux différents âges et ne sont pas les mêmes pour les méningites à pneumocoque, les otites ou les pneumonies.
Cette variabilité des sérotypes impliqués dans les manifestations cliniques et présents dans le pharynx est due à la grande capacité d’adaptation de cette bactérie.
Les différents sérotypes peuvent échanger du matériel génétique entre eux et ainsi modifier leurs antigènes capsulaires pour échapper aux anticorps dirigés contre eux : c’est ce qu’on appelle le switch capsulaire.
Le phénomène de remplacement
Le pneumocoque est aussi capable de s’adapter aux pressions de sélection, telle celle exercée par le vaccin, en remplaçant des souches présentes dans le vaccin par d’autres : c’est le phénomène de remplacement.
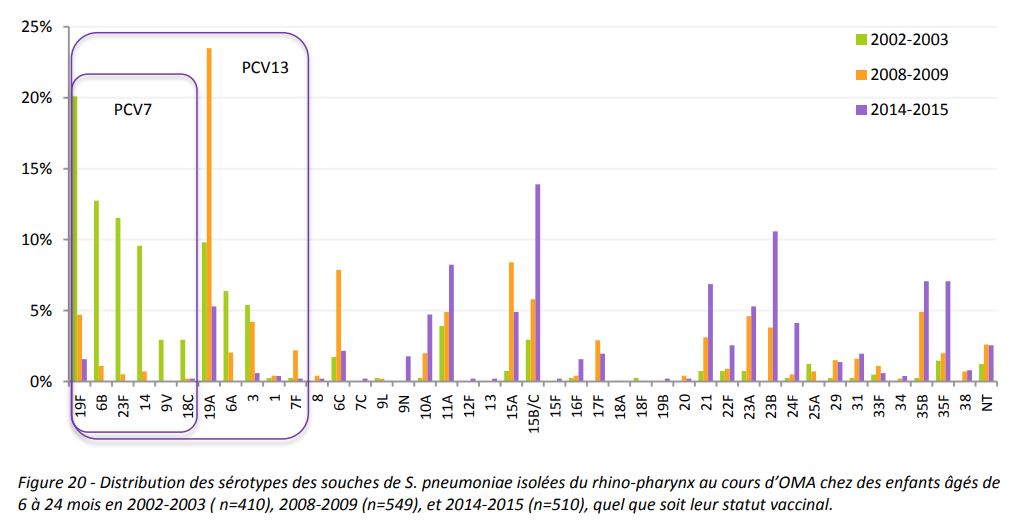
Le Prevenar 7, contenant 7 sérotypes du pneumocoque introduit en France au début des années 2000, était conçu par le laboratoires américain Wyeth pour combattre les infections invasives dues au pneumocoque chez les enfants de moins de 5 ans aux Etats-Unis. Dans ce pays, il couvrait plus de 95% des sérotypes retrouvés dans des infections invasives dans cette tranche d’âge mais seulement 65% des sérotypes des enfants de moins de deux ans en France.

Aux Etats-Unis le vaccin fut généralisé d’emblée.
L’idée était de diminuer le portage rhinopharyngé du pneumocoque par les jeunes enfants afin de diminuer la fréquence globale des infections graves à pneumocoque. On pensait que la diminution allait être proportionnelle à la présence des sérotypes couverts par le vaccin. Par effet indirect, on pensait pouvoir diminuer dans des proportions semblables l’ensemble des infections invasives à pneumocoque dans la population.
Ces projections péchaient, comme souvent s’agissant de vaccins, par un excès d’optimisme.
En France, le CSHPF (Conseil Supérieur d’hygiène publique de France) voulut d’abord limiter la recommandation de vaccination aux groupes à risque et aux enfants exposés à la vie en collectivité ou avec des fratries nombreuses. La crainte du comité était aussi qu’un phénomène de remplacement des sérotypes ne se produise neutralisant ainsi l’effet positif du vaccin d’un point de vue de santé publique. Il estimait que l’effet espéré du vaccin, à savoir éviter de 8 à 45 décès par an et 54 séquelles, n’était pas suffisant pour justifier une vaccination universelle, compte tenu du risque de remplacement des souches et des effets indésirables10CSHPF, Avis du CSHPF du 8 mars 2002 relatif à la vaccination par le vaccin pneumococcique heptavalent conjugué – Prevenar.

Mais sous la pression commerciale du laboratoire, les pédiatres, en dehors de toute recommandation officielle, élargirent la cible vaccinale en vaccinant 50% des enfants de moins de deux ans en 2006. Le CSHPF, subissant lui aussi les pressantes demandes du laboratoire et des experts prit acte de cette situation et recommanda le vaccin pour la vaccination universelle des nourrissons en juin 2006.
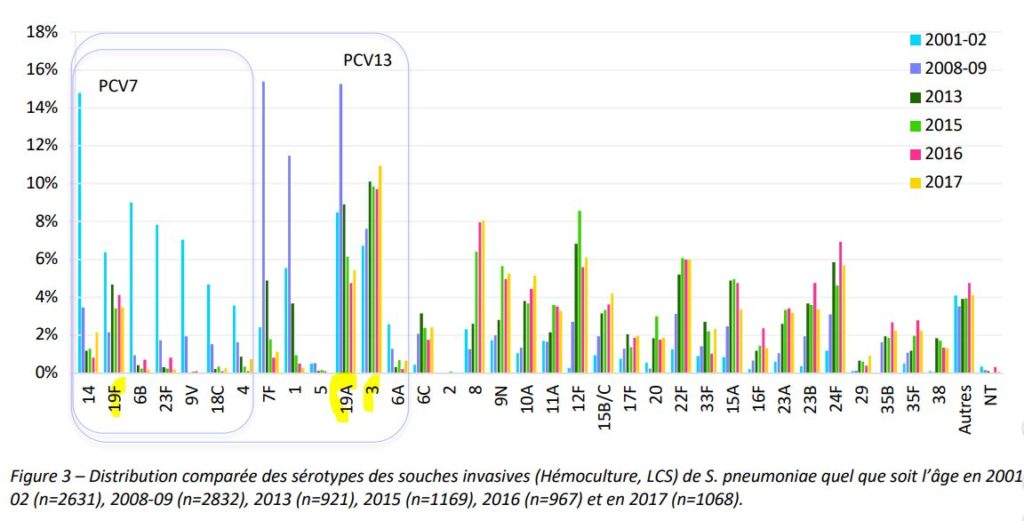
Néanmoins, comme le résume un avis du HCSP daté de 201211HCSP, Vaccination des nourrissons contre les infections invasives à pneumocoque par le vaccin pneumococcique conjugué 13 valent, 02/02/2012, la généralisation du vaccin produisit une pression de sélection forte sur le pneumocoque provocant le phénomène redouté par le CHSPF en 2002, le remplacement des souches présentes dans le vaccin12La méningite à pneumocoque gagne du terrain en France, Le Figaro, 16/10/2011.



Un autre phénomène inquiétant, qui n’avait pas été anticipé, se produisit sous la pression du vaccin, l’émergence rapide d’un sérotype peu présent auparavant, multirésistant aux antibiotiques et souvent létal, le sérotype 19A. Celui-ci devint prédominant chez les enfants de moins de deux ans, représentant jusqu’à 30% des sérotypes impliqués dans des infections invasives à cet âge.
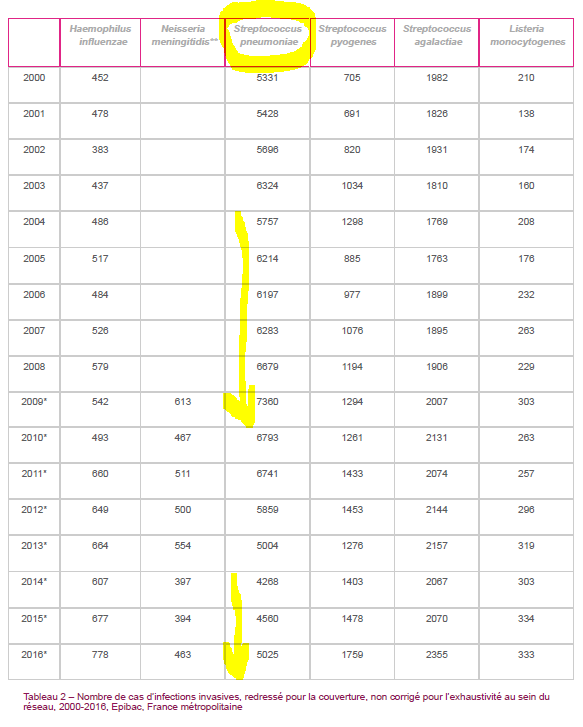
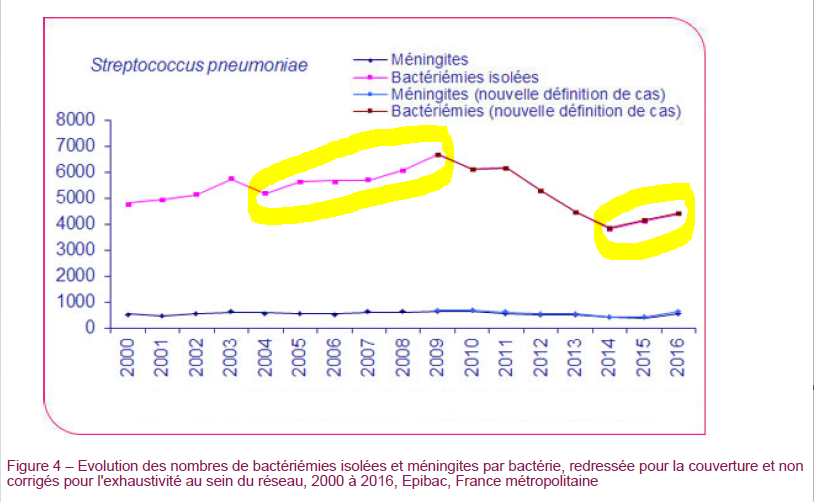
A partir de 2004, la généralisation de la vaccination se traduisit par le remplacement rapide dans toutes les tranches d’âge des souches présentes dans le vaccin. Il y eut une diminution modérée de la fréquence des infections invasives avant l’âge de deux ans avec une augmentation de la proportion des sérotypes 19A mais une augmentation de la fréquence des infections invasives à pneumocoque dans toutes les autres tranches d’âge.
1618 cas supplémentaires d’infection invasive à pneumocoque
Les infections avant 2 ans ne représentant que 5 à 10% de l’ensemble des infections invasives à pneumocoque, pendant la période entre 1998 -2002 et 2008-2009, il y eut, d’après le HCSP, 1618 cas supplémentaires d’infection invasive à pneumocoque dans l’ensemble de la population chaque année faisant passer leur nombre de 3800 à 5400 par an environ.
En 2006, déjà, dans la population des moins de 18 ans, il y avait plus de méningites à pneumocoque chez les vaccinés que chez les non vaccinés13Lévy, Méningites à pneumocoque de l’enfant en France : 832 cas de 2001 à 2007, Archives de pédiatrie
Volume 15, n° S3.
Effets secondaires du Prevenar 7V
Malgré cette augmentation globale du nombre de cas d’infections invasives, malgré les échecs vaccinaux de plus en plus nombreux et les effets indésirables graves constatés par la pharmacovigilance, parmi lesquels des décès de nourrissons, le HCSP ne souhaita pas revenir sur les recommandations de vaccination universelle.
On peut légitimement penser qu’entre 2006 et 2010 la vaccination fut non seulement inutile mais nuisible à la santé publique ne faisant que contribuer à augmenter le nombre d’infections invasives et provoquant, de plus, de nombreux effets indésirables.
En ce qui concerne les effets indésirables graves, nécessitant des hospitalisations, pouvant laisser des séquelles ou causant le décès, leur fréquence selon les déclarations spontanées varie d’une période à l’autre. Lors de la première période de vaccination ciblée, pendant 19 mois, où on vaccina les enfants à risque et où l’on mit en place une pharmacovigilance renforcée on déclara 8,4 effets indésirables graves ou inattendus pour 100 000 actes (mais pas de décès). Cela correspond environ à 20 effets indésirables graves pour 100 000 vaccinés ou un effet indésirable grave pour 5000 enfants vaccinés. Dans 67% des cas le Prevenar était administré seul14Bensouda-Grimaldi, Suivi de pharmacovigilance du vaccin Prevenar , Archives de pédiatrie, janvier 2007..
Pendant la période de surveillance suivante, de 2004 à 2007, où la surveillance n’était plus renforcée, 221 effets indésirables graves soit un taux de 2,8 effets indésirables graves pour 100 000 doses furent déclarés. Parmi ces effets indésirables des convulsions hyperthermiques, des purpuras thrombopéniques, des décès considérés comme des morts subites et 60 cas d’infections invasives à pneumocoques dont 43 méningites. Le sérotype était connu dans 32 cas et il s’agissait du 19A dans 12 cas c’est-à-dire dans 37% des cas où le sérotype était connu. Dans 70% des 221 effets indésirables graves, les nourrissons guérirent sans séquelles, dans 15 cas ils gardèrent des séquelles, il y eut 12 cas d’évolution fatale, dont 11 suite à des infections à pneumocoque15Commission nationale de pharmacovigilance du 27 janvier 2009..
Ces 12 décès en 39 mois représentent un nombre important quand on sait que, avant la vaccination, entre 2000 et 2002, le nombre de décès annuels dus à des infections invasives à pneumocoque chez les nourrissons de moins de un an était de 9 en moyenne.
Introduction du Prevenar 13V
En 2010 fut introduit un nouveau vaccin, le Prevenar 13, contenant six sérotypes supplémentaires dont le 19A.
Ce nouveau vaccin permit de réduire jusqu’à environ 28% l’incidence globale des infections invasives à pneumocoque et jusqu’à 66% celle des nourrissons de moins de un an. Mais, dès 2015, son efficacité s’épuisait de par le remplacement des sérotypes vaccinaux et l’incidence des infections invasives à pneumocoque augmentait à nouveau, en particulier chez les nourrissons de moins de un an (cf Epibac).
Le dernier bilan de pharmacovigilance, en 2015, montrait, entre 2010 et fin 2014, donc sur 5 ans, 252 effets indésirables graves soit un pour 12000 enfants vaccinés et 12 décès dont 5 ont été jugés imputables au vaccin16Réunion du Comité technique de pharmacovigilance du 17 mars 2015..
Bilan
Le bilan de 13 années de vaccination est une diminution de 1,8% de l’incidence globale des infections invasives à pneumocoque par rapport à la période allant de 1998 à 2002 comparée à l’ensemble de la période de vaccination (de 9,16 pour 100 000 à 8,99 pour 100 000).
Tandis que les effets indésirables graves seraient au minimum de 70 à 160 par cohorte d’enfants vaccinés chaque année selon les déclarations spontanées d’effets indésirables . Si on estime que quelques 8 millions de nourrissons ont été vaccinés cela représenterait au moins 700 à 1600 effets indésirables graves chez des nourrissons.
Pendant la période de vaccination, le portage pharyngé chez les enfants de 6 à 23 mois est passé de 71 à 60% et n’a pas été réduit de manière importante. De plus les sérotypes qui ont remplacé ceux présents dans le rhinopharynx à la période pré-vaccinale ont le même potentiel pour générer des infections invasives (Centre National de Référence pneumocoque, rapport 2015).
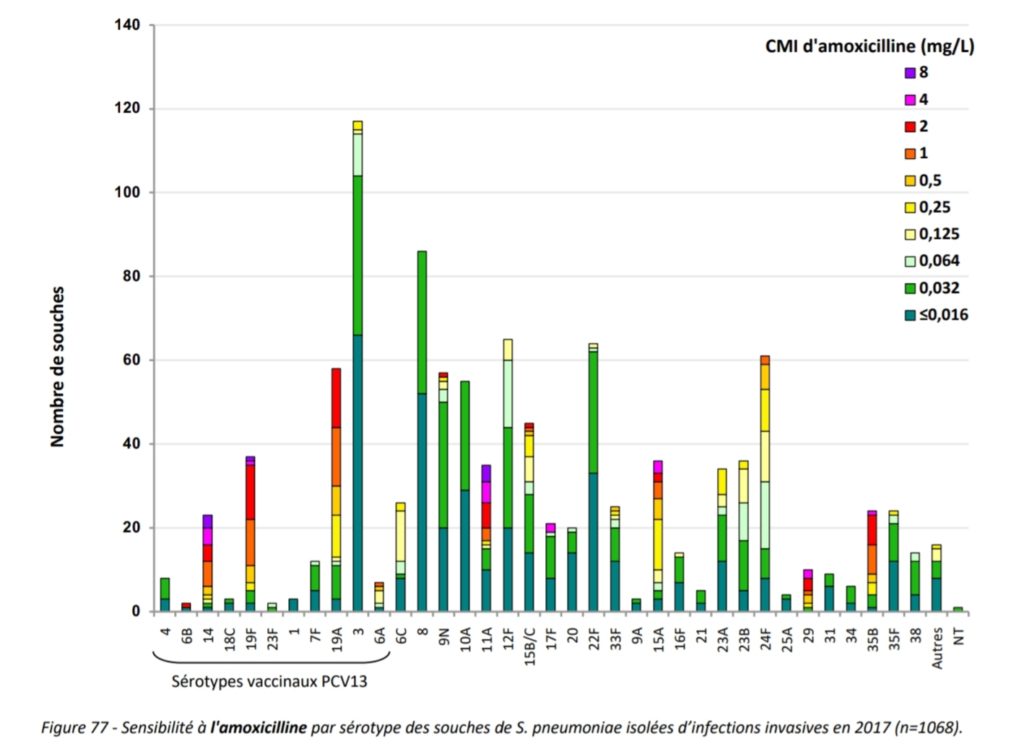
Enfin, le vaccin perd actuellement son efficacité sur plusieurs sérotypes vaccinaux qui s’y sont adaptés : il s’agit des sérotypes 3 et 19F et surtout du 19A dont nous avons évoqué la virulence particulière.
Le bénéfice du vaccin sur les pneumonies ou les otites n’a pas été démontré en France mais uniquement aux Etats-Unis, dans le cadre d’études de faible qualité financées par le laboratoire commercialisant le Prevenar.
Le cas de la France n’est pas isolé en Europe et la réduction de l’incidence des infections invasives à pneumocoque dans les pays nordiques, avec des couvertures vaccinales très élevées, n’a pas dépassé 20% .
Pour l’aspect financier, le vaccin Prevenar représente pour le laboratoire Pfizer un chiffre d’affaires de 6 milliards de dollars chaque année soit environ 12% de son chiffre d’affaires.
Note : Prix du vaccin en 2002 : 63,45€ soit 190,35€ pour 3 doses. Prix en 2017 : 56,24€ soit 168,72€ pour 3 doses.